元素氧化态列表
该列表主要参考《元素化学》(Chemistry of the Elements)[1],显示出元素周期律在元素价态上的一些趋势。[2]
| Nu | ||||||||||||||
| −1 | H | +1 | ||||||||||||
| He | ||||||||||||||
| −1 | Li | +1 | ||||||||||||
| Be | +1 | +2 | ||||||||||||
| -1 | B | +1 | +2 | +3 | [3] | |||||||||
| −4 | −3 | −2 | −1 | C | +1 | +2 | +3 | +4 | ||||||
| −3 | −2 | −1 | N | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| −2 | −1 | O | +1 | +2 | ||||||||||
| −1 | F | |||||||||||||
| Ne | ||||||||||||||
| −1 | Na | +1 | ||||||||||||
| Mg | +1 | +2 | [4] | |||||||||||
| Al | +1 | +2 | +3 | |||||||||||
| −4 | −3 | −2 | −1 | Si | +1 | +2 | +3 | +4 | ||||||
| −3 | −2 | −1 | P | +1 | +2 | +3 | +4 | +5 | ||||||
| −2 | −1 | S | +1 | +2 | +3 | +4 | +5 | +6 | ||||||
| −1 | Cl | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||||||
| Ar | ||||||||||||||
| K | +1 | |||||||||||||
| Ca | +1 | +2 | ||||||||||||
| Sc | +1 | +2 | +3 | |||||||||||
| −2 | −1 | Ti | +1 | +2 | +3 | +4 | ||||||||
| −1 | V | +1 | +2 | +3 | +4 | +5 | ||||||||
| −2 | −1 | Cr | +1 | +2 | +3 | +4 | +5 | +6 | ||||||
| −3 | −2 | −1 | Mn | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||||
| −2 | −1 | Fe | +1 | +2 | +3 | +4 | +5 | +6 | +7 [5] | |||||
| −1 | Co | +1 | +2 | +3 | +4 | +5 | ||||||||
| −1 | Ni | +1 | +2 | +3 | +4 | |||||||||
| Cu | +1 | +2 | +3 | +4 | ||||||||||
| Zn | +1 | +2 | [6] | |||||||||||
| Ga | +1 | +2 | +3 | |||||||||||
| −4 | −3 | −2 | −1 | Ge | +1 | +2 | +3 | +4 | ||||||
| −3 | As | +1 | +2 | +3 | +5 | |||||||||
| −2 | Se | +1 | +2 | +4 | +6 | |||||||||
| −1 | Br | +1 | +3 | +4 | +5 | +7 | ||||||||
| Kr | +1 | +2 | ||||||||||||
| Rb | +1 | |||||||||||||
| Sr | +1 | +2 | ||||||||||||
| Y | +1 | +2 | +3 | |||||||||||
| −2 | Zr | +1 | +2 | +3 | +4 | |||||||||
| −1 | Nb | +2 | +3 | +4 | +5 | |||||||||
| −2 | −1 | Mo | +1 | +2 | +3 | +4 | +5 | +6 | ||||||
| −3 | −1 | Tc | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||||
| −2 | Ru | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | |||||
| −1 | Rh | +1 | +2 | +3 | +4 | +5 | +6 | |||||||
| Pd | +1 | +2 | +4 | +6 | ||||||||||
| Ag | +1 | +2 | +3 | |||||||||||
| Cd | +1 | +2 | ||||||||||||
| -5[9] | −2 | −1 | In | +1 | +2 | +3 | ||||||||
| −4 | Sn | +1 | +2 | +3 | +4 | |||||||||
| −3 | Sb | +3 | +5 | |||||||||||
| −2 | Te | +2 | +4 | +5 | +6 | |||||||||
| −1 | I | +1 | +3 | +5 | +7 | |||||||||
| Xe | +1 | +2 | +4 | +6 | +8 | |||||||||
| Cs | +1 | +5 | ||||||||||||
| Ba | +2 | |||||||||||||
| La | +2 | +3 | ||||||||||||
| Ce | +1 | +2 | +3 | +4 | ||||||||||
| Pr | +2 | +3 | +4 | +5 | ||||||||||
| Nd | +2 | +3 | ||||||||||||
| Pm | +2 | +3 | ||||||||||||
| Sm | +1 | +2 | +3 | +4 | ||||||||||
| Eu | +1 | +2 | +3 | |||||||||||
| Gd | +1 | +2 | +3 | |||||||||||
| Tb | +1 | +2 | +3 | +4 | ||||||||||
| Dy | +1 | +2 | +3 | |||||||||||
| Ho | +1 | +2 | +3 | |||||||||||
| Er | +1 | +2 | +3 | |||||||||||
| Tm | +2 | +3 | ||||||||||||
| Yb | +1 | +2 | +3 | |||||||||||
| Lu | +1 | +2 | +3 | |||||||||||
| −2 | Hf | +1 | +2 | +3 | +4 | |||||||||
| −1 | Ta | +2 | +3 | +4 | +5 | |||||||||
| −2 | −1 | W | +1 | +2 | +3 | +4 | +5 | +6 | ||||||
| −3 | −1 | Re | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||||
| −2 | −1 | Os | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | ||||
| -3 | −1 | Ir | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | +9 | [10][11][12] | ||
| −3 | −2 | −1 | Pt | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| −1 | Au | +1 | +2 | +3 | +4 | +5 | ||||||||
| Hg | +1 | +2 | +4 | [13] | ||||||||||
| Tl | +1 | +2 | +3 | |||||||||||
| −4 | Pb | +1 | +2 | +3 | +4 | |||||||||
| −3 | −2 | −1 | Bi | +1 | +2 | +3 | +4 | +5 | ||||||
| −2 | Po | +2 | +4 | +6 | ||||||||||
| −1 | At | +1 | +3 | +5 | +7 | |||||||||
| Rn | +2 | +6 | [14] | |||||||||||
| Fr | +1 | |||||||||||||
| Ra | +2 | |||||||||||||
| Ac | +3 | |||||||||||||
| Th | +1 | +2 | +3 | +4 | ||||||||||
| Pa | +2 | +3 | +4 | +5 | ||||||||||
| U | +1 | +2 | +3 | +4 | +5 | +6 | ||||||||
| Np | +3 | +4 | +5 | +6 | +7 | |||||||||
| Pu | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | ||||||
| Am | +2 | +3 | +4 | +5 | +6 | +7 | ||||||||
| Cm | +3 | +4 | ||||||||||||
| Bk | +3 | +4 | ||||||||||||
| Cf | +2 | +3 | +4 | |||||||||||
| Es | +2 | +3 | +4 | |||||||||||
| Fm | +2 | +3 | ||||||||||||
| Md | +2 | +3 | ||||||||||||
| No | +2 | +3 | ||||||||||||
| Lr | +3 | |||||||||||||
| Rf | +4 | |||||||||||||
| Db | +5 | |||||||||||||
| Sg | +6 | |||||||||||||
| Bh | +7 | |||||||||||||
| Hs | +8 | |||||||||||||
| Mt | ||||||||||||||
| Ds | ||||||||||||||
| Rg | ||||||||||||||
| Cn | ||||||||||||||
| Nh | ||||||||||||||
| Fl | ||||||||||||||
| Mc | ||||||||||||||
| Lv | ||||||||||||||
| Ts | ||||||||||||||
| Og |
元素氧化态列表列出化学元素的所有已知整数氧化态,常见氧化态以粗体标记,所有元素单质氧化态为零。
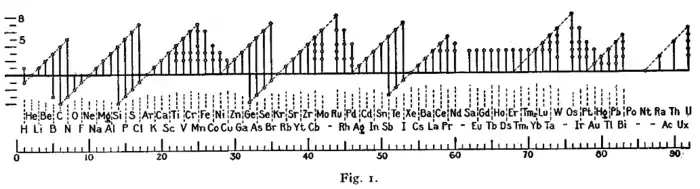
下图是欧文·朗缪尔1919年在研究八隅体规则时所画:[15]
参考资料
- Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements, 2nd Edition, Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4, p. 28.
- 灰色行的元素是惰性气体。
- 超导材料二硼化镁中硼的氧化态是-1。
- 含有Mg(I)的低价镁化合物已经用大配体制得,参见:Green, S. P.; Jones C.; Stasch A. . Science. December 2007, 318 (5857): 1754–1757. PMID 17991827. doi:10.1126/science.1150856. 。
- Lu, J. B., Jian, J., Huang, W., Lin, H., Li, J., & Zhou, M. (2016). Experimental and theoretical identification of the Fe (vii) oxidation state in FeO 4−.Physical Chemistry Chemical Physics,18(45), 31125-31131.
- Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils;. . 91–100. Walter de Gruyter. 1985: 1034–1041. ISBN 3-11-007511-3 (德语).
- . WebElements.com. [2007-12-10]. (原始内容存档于2008-05-13).
- . OpenMOPAC.net. [2007-12-10]. (原始内容存档于2011-07-23).
- Guloy, A. M.; Corbett, J. D. . Inorganic Chemistry. 1996, 35 (9): 2616–22. doi:10.1021/ic951378e.
- Ir(-III)存在于Ir(CO)33−中,参见Greenwood, N. N.; Earnshaw, A. 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.。
- Ir(VIII)存在于四氧化铱中,参见Gong, Yu; Zhou, Mingfei, Kaupp, Martin, Riedel, Sebastian. . Angewandte Chemie. 2009-10-04, 121 (42): 8019–8023. doi:10.1002/ange.200902733.
- Wang, Guanjun; Zhou, Mingfei; Goettel, James T.; Schrobilgen, Gary G.; Su, Jing; Li, Jun; Schlöder, Tobias; Riedel, Sebastian. . Nature. 2014, 514: 475–477. Bibcode:2014Natur.514..475W. PMID 25341786. doi:10.1038/nature13795.
- Hg(IV)存在于四氟化汞中,参见Xuefang Wang; Lester Andrews; Sebastian Riedel; and Martin Kaupp. . Angew. Chem. Int. Ed. 2007, 46 (44): 8371–8375. doi:10.1002/anie.200703710. 。
- Rn2+存在于二氟化氡中,参见Stein, L. . Science. 1970, 168: 362. doi:10.1126/science.168.3929.362.和Kenneth S. Pitzer. . J. Chem. Soc., Chem. Commun.,. 1975: 760b – 761. doi:10.1039/C3975000760b.。
- Irving Langmuir. The arrangement of electrons in atoms and molecules. J. Am. Chem. Soc. 1919, 41, 868-934. doi:10.1021/ja02227a002
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.