硫氰酸铵
硫氰酸銨是一種由铵离子和硫氰酸根组成的无机铵盐,分子式為NH4SCN,在空气中易潮解,溶于水时呈吸热反应,170℃时与硫化氢反应分解为氨和二硫化碳,可用於除草剂。
| 硫氰酸铵 | |||
|---|---|---|---|
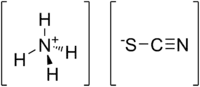 | |||
| |||
| 识别 | |||
| CAS号 | 1762-95-4 | ||
| PubChem | 15666 | ||
| ChemSpider | 14901 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | SOIFLUNRINLCBN-UHFFFAOYAF | ||
| ChEBI | 30465 | ||
| RTECS | XN6465000 | ||
| 性质 | |||
| 化学式 | NH4SCN | ||
| 摩尔质量 | 76.122 g/mol g·mol⁻¹ | ||
| 外观 | 无色易潮解的晶体 | ||
| 密度 | 1.305 g/cm3 | ||
| 熔点 | 149.5 °C(423 K) | ||
| 沸点 | 170 °C (decomp) | ||
| 溶解性(水) | 128 g/100 mL (0 °C) | ||
| 溶解性 | 溶于液氨、醇类、丙酮 | ||
| 结构 | |||
| 晶体结构 | 单斜晶系 | ||
| 危险性 | |||
欧盟危险性符号[1] 有害 Xn 有害 Xn | |||
| 警示术语 | R:R20, R21, R22, R37, R38 | ||
| 安全术语 | S:S26, S36 | ||
| MSDS | External MSDS | ||
| 主要危害 | 不可食用,對皮膚和呼吸系統造成刺激 | ||
| NFPA 704 |
 1
2
1
| ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
NH4SCN+H2S->2 NH3+CS2
合成方法
硫氰酸銨是由二硫化碳和氨水反应得到,这个反应会生成中间体二硫代氨基甲酸铵,经加热后分解成硫氰酸銨和硫化氢:
- CS2 + 2 NH3(aq) → NH2C(=S)SNH4 → NH4SCN + H2S
外部連結
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.


