Knorr喹啉合成
Knorr喹啉合成(Knorr quinoline synthesis),由德国化学家路德维希·克诺尔(Ludwig Knorr,1859-1921)在1886年首先报道。[1]
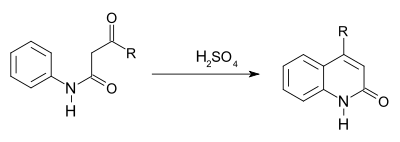
Knorr喹啉合成
此反应是一种亲电芳香取代反应,总过程消除一分子水。
1964年 Staskun 研究发现在特定条件下4-羟基喹啉是反应的副产物。[2] 例如,苯甲酰基乙酰苯胺 (1)在远过量的多聚磷酸催化下生成的产物是2-羟基喹啉 (2),不过如果用少量的多聚磷酸催化,则会生成4-羟基喹啉 (3)。 Staskun 提出如下 N,O-双正离子和 N-正离子中间体以解释这两个产物在不同酸性条件下的生成。

Staskun 1964 Knorr环化机理
2007年 Klumpp 等利用理论计算和核磁共振谱结果,提出超亲电性的 O,O-二正离子中间体在反应条件下比 N,O-二正离子更容易生成。而且他们还发现质子酸性的三氟甲磺酸是此反应最有效的酸催化剂。[3]
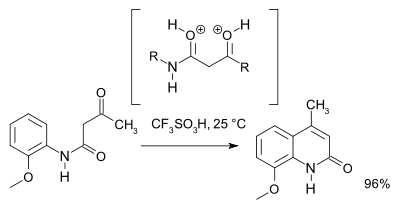
Knorr环化 三氟甲磺酸 Sai 2007
参见
参考资料
- Ludwig Knorr. . Justus Liebig's Annalen der Chemie. 1886, 236 (1-2): 69–115. doi:10.1002/jlac.18862360105.
- B. Staskun. . J. Org. Chem. 1964, 29 (5): 1153–1157. doi:10.1021/jo01028a038.
- Kiran Kumar Solingapuram Sai, Thomas M. Gilbert, and Douglas A. Klumpp. . J. Org. Chem. 2007, 72: 9761–9764. doi:10.1021/jo7013092.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.