叠氮化亚铊
叠氮化亚铊,化学式 TlN3,是一种黄棕色晶体,难溶于水。 尽管它对冲击或摩擦的敏感度不及叠氮化铅,但叠氮化亚铊仍然很容易被火焰或火花引爆。它可以安全干燥保存在密闭的非金属容器中。
| 叠氮化亚铊 | |
|---|---|
 | |
| 别名 | 叠氮化铊 |
| 识别 | |
| CAS号 | 53027-05-7 |
| PubChem | 22764821 |
| ChemSpider | 15368504 |
| SMILES |
|
| InChI |
|
| InChIKey | GMUSFHMEMWCQIE-UHFFFAOYAP |
| 性质 | |
| 化学式 | TlN3 |
| 摩尔质量 | 246.4035 g·mol⁻¹ |
| 外观 | 黄棕色 |
| 溶解性(水) | 不可溶 |
| 结构 | |
| 晶体结构 | 四方晶系, tI16 [1] |
| 空间群 | I4/mcm, No. 140 |
| 危险性 | |
| 欧盟分类 | |
| 主要危害 | 剧毒 |
| NFPA 704 |
 0
4
3
|
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
制备和结构
叠氮化亚铊可以由硫酸亚铊水溶液和叠氮化钠化合而成。 叠氮化亚铊将沉淀,通过冷却可以使产量最大化。
TlN3、KN3、RbN3和 CsN3 有一样的结构。 叠氮阴离子以偏光方向与八个阳离子结合。这些阳离子结合到八个末端N的中心。 [2]
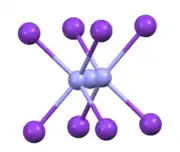
叠氮化钾/铷/铯/亚铊的结构
危险性
所有的铊化合物都有毒并应小心处理。此外,必须避免吸入任何含叠氮化亚铊的灰尘或烟雾。
参考资料
- Mauer F.A.; Hubbard C.R.; Hahn T.A. . J. Chem. Phys. 1973, 59 (7): 3770–3776. doi:10.1063/1.1680549.
- Ulrich Müller "Verfeinerung der Kristallstrukturen von KN3, RbN3, CsN3 und TIN3" Zeitschrift für anorganische und allgemeine Chemie 1972, Volume 392, 159–166. doi:10.1002/zaac.19723920207
| 含有叠氮离子的化合物 | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HN3 | He | ||||||||||||||||||
| LiN3 | Be(N3)2 | B(N3)3 | CH3N3, C(N3)4 |
N(N3)3,H2N—N3 | O | FN3 | Ne | ||||||||||||
| NaN3 | Mg(N3)2 | Al(N3)3 | Si(N3)4 | P | SO2(N3)2 | ClN3 | Ar | ||||||||||||
| KN3 | Ca(N3)2 | Sc(N3)3 | Ti(N3)4 | VO(N3)3 | Cr(N3)3, CrO2(N3)2 |
Mn(N3)2 | Fe(N3)2, Fe(N3)3 |
Co(N3)2, Co(N3)3 |
Ni(N3)2 | CuN3, Cu(N3)2 |
Zn(N3)2 | Ga(N3)3 | Ge | As | Se(N3)4 | BrN3 | Kr | ||
| RbN3 | Sr(N3)2 | Y | Zr(N3)4 | Nb | Mo | Tc | Ru(N3)63− | Rh(N3)63− | Pd(N3)2 | AgN3 | Cd(N3)2 | In | Sn | Sb | Te | IN3 | Xe(N3)2 | ||
| CsN3 | Ba(N3)2 | Hf | Ta | W | Re | Os | Ir(N3)63− | Pt(N3)62− | Au(N3)4− | Hg2(N3)2, Hg(N3)2 |
TlN3 | Pb(N3)2 | Bi(N3)3 |
Po | At | Rn | |||
| Fr | Ra(N3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La | Ce(N3)3, Ce(N3)4 |
Pr | Nd | Pm | Sm | Eu | Gd(N3)3 | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Th | Pa | UO2(N3)2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.